海口奇力制药股份有限公司 570000
摘 要
目的:建立注射用奥扎格雷钠有关物质测定方法,并进行方法学验证,用于一致性评价样品有关物质检测研究;方法:以十八烷基硅烷键合硅胶为填充剂,流动相为0.3%醋酸铵溶液-甲醇(80:20),检测波长272nm,流速1.0ml/min,进样量:20µl。结果:本法在0.06µg/ml~1.11µg/ml浓度范围线性良好,相关系数R2值1.0;重复性试验与中间精密度试验有关物质结果一致,RSD为0,经信噪比法检测,本法定量限为0.05µg/ml,检测限为0.016µg/ml;专属性试验结果表明空白辅料及空白溶剂对检测无干扰,破坏试验产生的降解产物能与主成分有效分离;当流速、流动相比例、柱温、检测波长等色谱条件发生微小变化时,本法检测结果一致,方法耐用性良好。结论:本方法具有专属性强,灵敏度高,精密度、耐用性好的特点,且操作简单迅速,适用于注射用奥扎格雷钠有关物质检测。
关键词:奥扎格雷钠;有关物质;高效液相色谱法;方法学验证;
奥扎格雷钠为血栓烷合酶抑制剂,能阻碍前列腺素H2(PGH2) 生产血栓烷A2(TXA2),促使血小板所衍生的PGH2转向内皮细胞,内皮细胞用于合成PGI2,从而改善TXA2与PGI2的平衡异常。具有抑制血小板的聚集和扩张血管作用。【1】。
海口奇力制药于2008年仿制获批,批准文号为国药准字H20084367。按国发〔2015〕44号《国务院关于改革药品医疗器械审评审批制度的意见》【2】,本品需开展与原研或参比制剂一致性评价相关工作,本文探讨注射用奥扎格雷钠一致性评价用有关物质检测方法的建立并根据《药品质量标准分析方法验证指导原则》【3】进行方法学验证,评价该方法的适用性。
一、材料与试剂
1.1、仪器
岛津LC-2030CHT高效液相色谱仪(配备紫外检测器);奥豪斯EX125DZH型十万分之一电子天平;上海康仪PHS-3酸度计。
1.2、试剂
甲醇(色谱纯) 规格:4L 来源:TEDIA;
醋酸铵(分析纯) 规格:500g 来源:西陇科学;
1.3、供试品
仿制制剂:注射用奥扎格雷钠,批号为202101002、202101003、202101004,均为海口奇力制药生产。
参比制剂:注射用奥扎格雷钠 批号为992711,日本丸石制药株式会社生产。
1.4、对照品
奥扎格雷钠对照品,来源中国食品药品检定研究院,批号为100837-201102,含量:100.0%。
二、实验方法
2.1、色谱条件
采用汉邦科技Megres C18(4.6mm×150mm 5µM)或效能相当的色谱柱;以0.3%醋酸铵溶液-甲醇(80:20)为流动相,检测波长272nm,流速1.0ml/min,进样量:20µl。
2.2、溶液配制
系统适用性溶液:取奥扎格雷钠对照品适量,精密称定,加流动相溶解并定量稀释制成16µg/ml的溶液。
供试品溶液的制备:取供试品适量,加流动相定理稀释制得50µg/ml的溶液。
对照溶液:精密量取供试品溶液1ml,置200ml量瓶中,加流动相稀释至刻度。
2.3、测定法
照《中国药典》2020年版四部通则高效液相色谱法【4】,精密量取系统适用性溶液20µl注入高效液相色谱仪,理论塔板数按奥扎格雷钠峰计应不低于2000,奥扎格雷钠峰与相邻杂质峰的分离度应>1.5,再分别精密量取溶剂(流动相)、供试品溶液、对照溶液各20µl,依次注入液相色谱仪,等度洗脱,记录色谱图至主成份保留时间的2.5倍,按自身对照法计算供试品中有关物质含量。
三、实验结果
3.1、方法的建立
本法引用自《中国药典》2015年版增补本奥扎格雷甘露醇注射液(征求意见稿)有关物质测定方法,由于处方、辅料等不同,需要进行方法学验证,检查方法的适用性。
3.2、方法学验证结果
3.2.1、线性与范围
取奥扎格雷钠对照品适量,精密称定,加流动相溶解并定量稀释制成含奥扎格雷钠浓度分别为0.06µg/ml、0.11µg/ml、0.28µg/ml、0.56µg/ml、1.11µg/ml的系列对照品溶液,按照以上确定的色谱条件,分别进样20µl,峰面积分别为5255、12538、32679、67607、136806,以奥扎格雷钠的浓度为横坐标,峰面积为纵坐标,将峰面积与对应浓度值做直线回归,求得直线回归方程为y=124437x-1605.1,其相关系数R2=1.0。结果表明,奥扎格雷浓度在0.06~1.11µg/ml范围内线性关系良好。线性关系图见下图1。
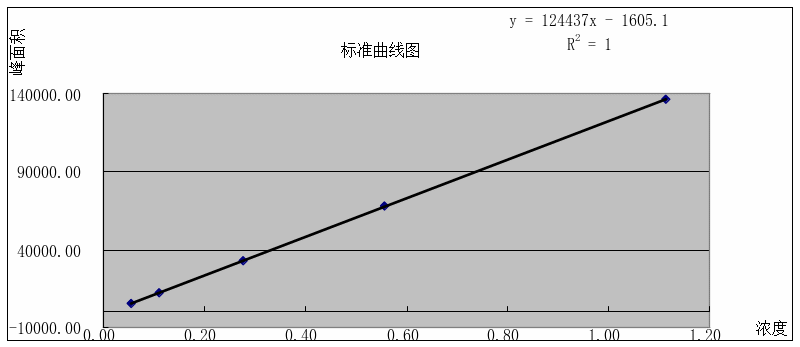
图1标准曲线图
3.2.2、精密度试验
3.2.2.1、重复性试验
由同一名实验员配制供试品溶液6份,依法进样检测,计算样品有关物质含量、均值及RSD值。6份样品有关物质结果基本一致,本法重复性良好。试验结果见下表1
表1 重复性试验
序号 | 最大未知单杂峰面积 | 最大未知单杂含量% | 总杂质峰面积 | 总杂质含量% |
1 | 2494 | 0.042% | 2494 | 0.042% |
2 | 2479 | 0.042% | 2479 | 0.042% |
3 | 2455 | 0.042% | 2455 | 0.042% |
4 | 2489 | 0.042% | 2489 | 0.042% |
5 | 2510 | 0.042% | 2510 | 0.042% |
6 | 2598 | 0.043% | 2598 | 0.043% |
平均值 | —— | 0.042% | —— | 0.042% |
RSD% | —— | 0.0% | —— | 0.0% |
3.2.2.2、中间精密度试验
次日,由于另一名实验员称同重复性试验方法配制6份供试品溶液,依法检测,计算样品含量、均值及RSD值。6份样品有关物质结果与重复性结果基本一致,本法中间精密度良好。试验结果见下表2
表2 中间精密度试验
序号 | 最大未知单杂峰面积 | 最大未知单杂含量% | 总杂质峰面积 | 总杂质含量% |
1 | 2588 | 0.044% | 2588 | 0.044% |
2 | 2649 | 0.044% | 2649 | 0.044% |
3 | 2615 | 0.043% | 2615 | 0.043% |
4 | 2600 | 0.044% | 2600 | 0.044% |
5 | 2621 | 0.045% | 2621 | 0.045% |
6 | 2606 | 0.043% | 2606 | 0.043% |
平均值 | —— | 0.044% | —— | 0.044% |
RSD% | —— | 0.0% | —— | 0.0% |
3.2.3、检测限与定量限试验
奥扎格雷钠无已知杂质对照品,该方法是采用自身对照法进行检测,采用奥扎格雷钠对照品进行定量限与检测限检测。
取奥扎格雷钠对照品适量,加入流动相定量稀释制成16µg/ml溶液,作为起始对照品溶液。用溶剂溶解并逐步稀释至信噪比约为10的溶液,作为定量限溶液,记录此时的信噪比;稀释至信噪比约为3的溶液,作为检测限溶液,记录此时的信噪比。
检测结果:将对照品溶液稀释至浓度为0.05µg/ml,检测信噪比为10.7,此浓度为本法定量限浓度,将对照品溶液稀释至浓度为0.016µg/ml,检测信噪比为3.3,此浓度为本法检测限浓度。
3.2.4、专属性试验
3.2.4.1、溶剂、辅料干扰试验
空白辅料溶液配制:取枸橼酸(供注射用)适量,加流动相定量稀释制成每1ml中约含枸橼酸0.56µg的溶液,作为空白辅料溶液。
测定方法:取溶剂(流动相)、空白辅料溶液及供试品溶液各20µl分别进样检测。
试验结果:溶剂、空白辅料对有关物质检测无干扰。
3.2.4.2、破坏降解产物分离试验
未破坏:取本品适量,加流动相溶解并稀释制成每1ml中约含0.05mg 的溶液。
氧化破坏:取本品适量(约含奥扎格雷钠2.5mg),置50ml量瓶中,加入2ml 3%的双氧水,室温放置2h后,加流动相稀释至刻度,摇匀,作为氧化破坏溶液;
酸破坏:取本品适量(约含奥扎格雷钠2.5mg),置50ml量瓶中,加入1M盐酸2ml,室温放置30min,用2ml 1M氢氧化钠溶液中和,加流动相稀释至刻度,摇匀,作为酸破坏溶液;
光照破坏:取4500Lx强光照20天的制剂样品,称取适量(约含奥扎格雷钠2.5mg),置50ml量瓶中,加流动相定量至刻度,摇匀,作为光照破坏溶液;
氧化空白:量取2ml 3%的双氧水置于50ml量瓶中,室温放置2h后,加流动相稀释至刻度,摇匀,作为氧化空白溶液;
酸碱空白:精密移取1M盐酸溶液2ml,置于50ml量瓶中,加1M氢氧化钠溶液3ml中和,加流动相稀释至刻度,摇匀,作为酸碱空白溶液;
测定法:取空白溶剂、氧化空白、酸碱空白及不同条件下破坏的样品各20ul,分别注入液相色谱仪,记录色谱图。奥扎格雷峰与相邻杂峰之间的分离度均应大于1.5。
试验结果:破坏试验产生的降解产物均与主成分有效分离(分离度>1.5)。
3.2.5、耐用性试验
耐用性是考察当色谱条件发生微小变化时方法对检测结果的影响程度。本试验考察变化条件为:①流速±0.1ml/min;②柱温±5℃;③流动相比例±2%;④检测波长±1nm。
试验结果表明:在色谱条件发生微小变化时,供试品溶液有关物质测定结果一致,方法耐用性良好,具体结果详见下表3。
表3 耐用性试验结果
色谱条件 | 最大未知杂质(%) | 总杂质(%) |
正常条件 | 0.043% | 0.043% |
流速:1.1ml/min | 0.041% | 0.041% |
流速:0.9ml/min | 0.043% | 0.043% |
柱温:30℃ | 0.042% | 0.042% |
柱温:35℃ | 0.044% | 0.044% |
流动相比例(82︰18) | 0.043% | 0.043% |
流动相比例(78︰22) | 0.041% | 0.041% |
检测波长:273nm | 0.045% | 0.045% |
检测波长:271nm | 0.043% | 0.043% |
3.3、注射用奥扎格雷钠样品含量测定结果
按本法检测202101002、202101003、202101004批注射用奥扎格雷钠成品样品有关物质结果见下表 ,均符合拟定质量标准有关物质项下“最大单个杂质应不得过0.2%,总杂质应不得过0.5%”的规定。
表4 耐用性试验结果
批号 | 最大单个杂质(%) | 总杂质(%) |
202101002(仿制制剂) | 0.044% | 0.044% |
202101003(仿制制剂) | 0.042% | 0.042% |
202101004(仿制制剂) | 0.041% | 0.041% |
992711(参比制剂) | 0.040% | 0.040% |
四、结论
本法引用自《中国药典》2015年版增补本奥扎格雷甘露醇注射液(征求意见稿)有关物质测定方法,操作简便、用时短、结果准确,各项方法学验证结果良好,适用于注射用奥扎格雷钠有关物质检测。
参考文献
[1] www.baidu.com百度百科 奥扎格雷钠
[2] 国发〔2015〕44号《国务院关于改革药品医疗器械审评审批制度的意见》
[3] 国家药典委员会 中国药典2020年版四部 通则9101药品质量标准分析方法验证指导原则
[4] 国家药典委员会 中国药典2020年版四部 通则0512高效液相色谱法