1、通讯作者:邓新立 ( 解放军总医院西院检验科 100853) 2、第一作者:黎晓晖 ( 解放军总医院西院检验科 100853) 3、吴明娟 ( 宇希生物科技(武汉)有限公司医学研究部 430040) 4、眭艺 ( 中国农业大学生物学院 100094)
摘要:阿尔茨海默病(Alzheimer's Disease,AD)是一种脑退行性疾患,患者的智力、记忆、感觉、定向、推理和判断能力都产生不可逆性的退化,严重危害人类健康。AD是引起痴呆最常见的病因,随着全球人口的老龄化,AD发病率也与日俱增,对社会和经济造成巨大影响。因此,早期检测、早期干预对提高AD高风险人群的生存质量和降低AD发病率意义重大。本文就AD早期检测生物学标志物及国内创新产业化检测试剂盒性能评价作一综述。
关键词:阿尔茨海默病; 生物标志物;Aβ1-42;p-tau-181
阿尔茨海默病(Alzheimer's Disease,AD)是一种脑退行性疾患,患者的智力、记忆、感觉、定向、推理和判断能力都产生不可逆性的退化,严重危害人类健康。流行病学调查显示,该疾病为继心、脑血管疾病、肿瘤之后的第四位死亡原因,严重威胁了老年人群的健康生活[1] 。对AD的诊断中,病理诊断常常被临床医学作为疾病诊断的金标准。但AD为大脑的病变,在病人的生前获取脑组织进行病理检测,属于有创性检查,难以让患者及家属接受,可行性差。神经影像被认为能够检测与AD有关的异常,但AD早期患者大脑无特异性形态学改变。因此,特异性生物标志物的检测是AD早检、早发现、早干预的关键。本文就国际公认的AD早期检测生物学标志物人β淀粉样蛋白1-42(Aβ1-42)、人过度磷酸化tau-181蛋白(p-tau-181)及国内创新产业化检测试剂盒性能评价作一综述。
1 AD发病与早检生物标志物
1.1 AD发病机理
AD的发病机制很复杂,现有多种假说,其中最经典的病理特征是老年斑(SP)和神经元纤维缠结(NFT)[2]:1)、β-淀粉样蛋白(Aβ)瀑布假说 人β淀粉样蛋白1-42(Aβ1-42)过度生成与清除失衡,并在大脑中沉积形成老年斑(SP),是AD发生的起始事件;2)、Tau蛋白假说 人过度磷酸化tau-181蛋白(P-tau-181)导致微管螺旋丝异常缠绕,破坏神经元及突触的正常功能,形成神经元纤维缠结(NFT)[3、4];3)、其他病理改变,如脑萎缩、选择性神经元丢失等。
1.2 AD发病进程
2011版NIA/AA诊断标准对AD进行重新定义,AD的整个发病进程分三个阶段:
(1)临床前期阶段: 该阶段尚无明确诊断标准,无临床症状,但可检测到生物标记物的改变。
(2)MCI阶段:包括MCI核心诊断标准、生物标记物在MCI和AD诊断中的应用和价值。
(3)痴呆阶段:基本沿用了1984版美国国立神经病、语言交流障碍和卒中研究所-老年性痴呆及相关疾病学会(NINCDS-ADRDA)标准。
患者痴呆阶段的临床症状出现则意味着已经进入AD晚期,而目前尚无药物对AD晚期患者进行有效的治疗。因此,建议将AD发病前十年乃至更长时间的“AD临床前期阶段”作为AD早检、早干预的窗口期。
1.3 AD早检生物标志物:Aβ1-42、p-tau-181
生物学标志物Aβ1-42和p-tau-181产生与AD的发病机理密切相关,被国际公认为AD早期检测的特异性标志蛋白。
(1)脑脊液检测
国内外大量文献报道,早在AD临床前期阶段,脑脊液中的Aβ1-42和p-tau-181浓度水平就开始发生特异性改变,且Aβ1-42的改变是AD发生的起始事件[5]。通过检测脑脊液样本中Aβ1-42和p-tau-181浓度水平可以早期筛查AD高风险人群并提高AD诊断准确率。但样本抽取属于有创性,需专业人员操作,受检者依从性较差。
(2)血清学检测
大脑中过度生成的Aβ1-42具很强的聚集力和神经毒性,其毒性作用会导致血-脑脊液屏障(BBB)通透性增加[6]。Aβ1-42和p-tau -181蛋白的产生增加会通过功能下降的血-脑脊液屏障(BBB)进入外周血液。通过检测外周血中Aβ1-42和p-tau -181蛋白浓度水平进行AD早期筛查和病情评估[7],大大提高了操作的便捷性,安全无风险且便于临床动态检测和疗效评估。彭丹涛[7]等通过分别检测健康人群、AD早期患者、AD中晚期患者血浆中Aβ1-42和p-tau -181
浓度,其结果存在统计学差异。该指标可以用于AD早期检测和辅助诊断。
2. Aβ1-42、p-tau-181检测试剂盒性能评价
深圳市安群生物工程有限公司生产的人β淀粉样蛋白1-42(Aβ1-42)检测试剂盒(酶联免疫法)和人磷酸化tau-181蛋白检测试剂盒(酶联免疫法)属于国内创新科研项目,现对这两个试剂盒的应用价值作初步性能评估。
根据国食药监械[2007]240号文件要求,将安群公司生产的人β淀粉样蛋白1-42(Aβ1-42)检测试剂盒(酶联免疫法)和人磷酸化tau-181蛋白检测试剂盒(酶联免疫法)分别与国外已批准上市的日本和光纯药工业株式会社的“Human β-Amyloid(1-42) ELISA Kit(Wako)”(简称Wako试剂盒)和美国R&D公司的“Human P-TAU-181 ELISA Kit”(简称R&D试剂盒)进行比对试验,并在对比试验基础上完善了临床补充性评价报告。原始资料保存地点:深圳市南山区人民医院、赣南医学院第一附属医院、湖南中医药大学第一附属医院.
2.1人β淀粉样蛋白1-42(Aβ1-42)检测试剂盒
经1012例临床样本的对比检测,安群试剂盒与Wako试剂盒比较,经Bland-Altman法分析,绝大多数差值都位于95%置信区间内,相关系数为0.992,两种试剂盒结果具有很好的一致性,表明安群试剂盒在测定人血清样本中的β淀粉样蛋白1-42(Aβ1-42)时与Wako试剂盒等效,能够符合临床上对β淀粉样蛋白1-42(Aβ1-42)的检测要求,可用于阿尔茨海默症的临床辅助诊断。
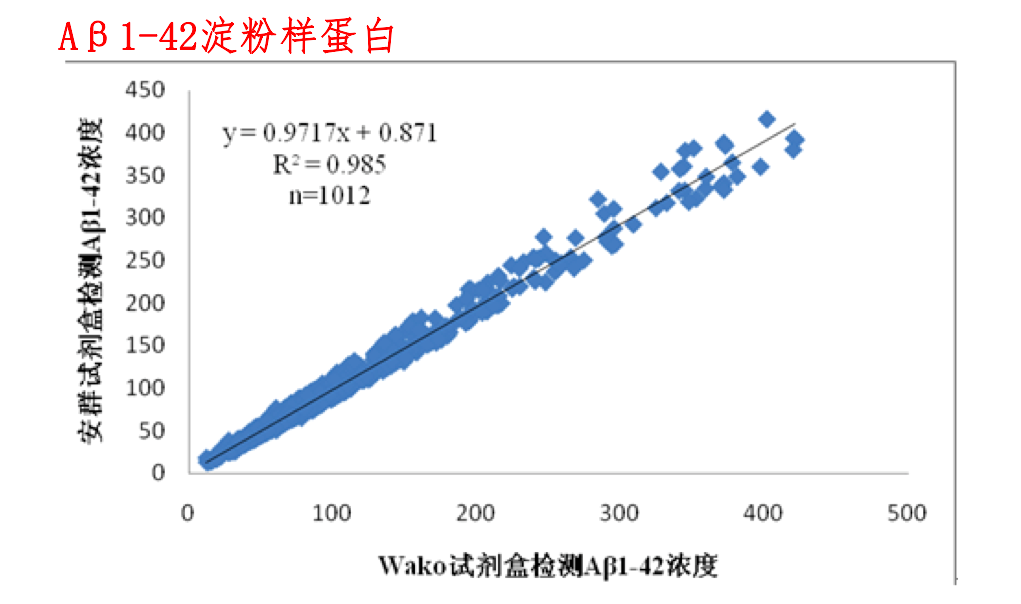
两种试剂盒测量1012例血清的Aβ1-42的散点图及回归方程
2.2人磷酸化tau-181(P-tau-181)检测试剂盒
经1012例临床样本的对比检测,安群试剂盒与R&D试剂盒比较,经Bland-Altman法分析,绝大多数差值都位于95%置信区间内,相关系数为0.985,两种试剂盒结果具有很好的一致性,表明安群试剂盒在测定人血清样本中的p-tau-181蛋白时与R&D试剂盒等效,能够符合临床上对磷酸化tau-181蛋白的检测要求,可用于阿尔茨海默症的临床辅助诊断。
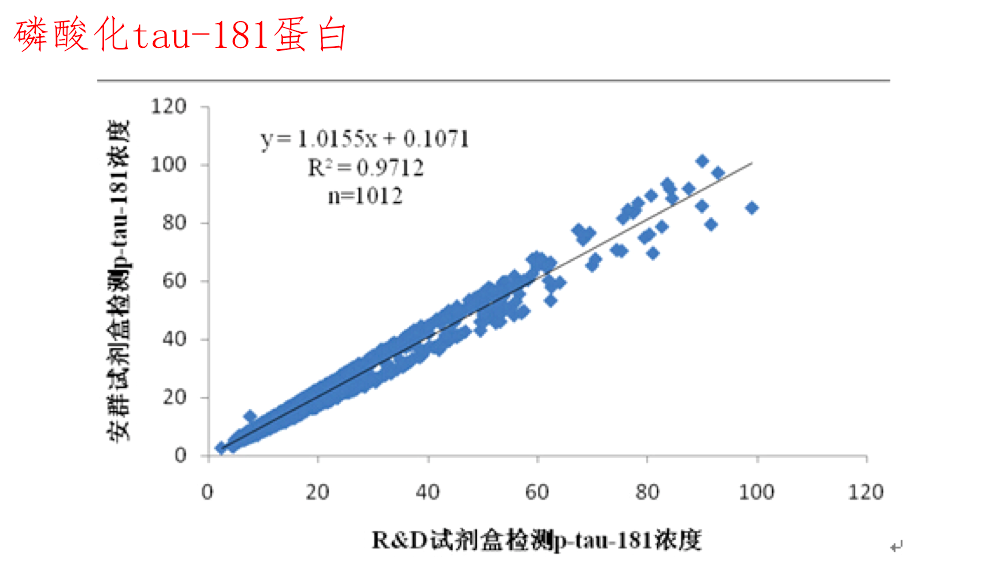
两种试剂盒测量1012例血清的p-tau-181的散点图及回归方程
3 结果与讨论
3.1 结果
早在2012年国际AD协会多名专家就已经联名撰文呼吁[8]:研究者应着力寻找AD血液学标志物。目前,血清标志物对AD早检是全新的技术突破,为AD高风险人群的早期筛查带来福音,并为临床医生对AD病情评估及疗效动态观察提供了辅助依据。
3.2 讨论
早期AD患者血液中Aβ1-42浓度升高显著,但随着病情加重Aβ1-42在大脑中不断沉积形成老年斑并导致血管淀粉样变,因此AD中晚期患者Aβ1-42游离浓度有所下降。据报道,AD患者大脑中血管淀粉样变与老年斑同时发生,甚至比老年斑的产生更早[9]。而p-tau-181蛋白的改变则与AD病情进展呈正相关,这与试剂盒临床补充性评价中p-tau-181检测的灵明度略高于Aβ1-42的结论相一致。
另外,除上述两种标志物,有文献报道AD患者血液中存在24s羟基胆固醇、血小板APP异构体比值、载脂蛋白E、白细胞介素、血红素氧合酶、基质金属蛋白酶、高半胱氨酸(Hcy)、miRNAs等变化[10],但报道称这些指标灵敏度和特异性并不令人满意,仅作为参考指标使用[11、12]。
4 展望
安群试剂盒的问世属于国内首创,其参数指标的设定更多的依赖了与国外试剂的对比,希望在使用过程中不断进行技术提升和完善,创造出更多的社会价值。
参考文献:
[1] Blennow K, de Leon MJ, Zetterberg H . Alzheimer's Disease [J] .Lancet, 2006 , 368 (9533) :387-403.
[2] Edited by Suzanne De La Monte. Alzheimer’s Disease Pathogenesis-Core Concepts, Shifting Paradigms and Therapeutic Targets. 2011:458-460.
[3] Thurston VC, Zinkowski RP, Binder LI. Tau as a nucleolar protein in human nonneural cell in vitro and in vivo[J]. Chromosoma , 1996, 105:20-30.
[4] Martin I, Mari B, Eirikur B, et al. Tau immunoreactivity detected in human plasma , but no obvious increase in dementia[j]. Dement Geriatr Cogn Disord, 1999,10:442-445.
[5] Jack CR Jr, et al. Lancet Neurol. Hypothetical model of dynamic biomarkers of the Alzheimer’s pathological cascade 2010 January ; 9(1): 119.
[6] 万文斌 夏世金 刘露梅 李亚明 阿尔茨诲默病中淀粉样蛋白损伤血脑屏障的干预新靶点:晚期糖化终产物受体 Journal of Chengdu Medical Colege 2013 Vol.8,No.4.
[7] Hampel H, Goernitz A, Buerger K. Advances in the development of biomarkers for Alzheimer disease: from CSF total tau and Aβ1-42 ptroteins to phosphorylated tau protein[J] . Brain Res Bull, 2003,61(3):243-253.
[8] Snyder HM , Carrillo MC, Grodstein F, et al. Developing novel blood-based biomarkers for Alzheimer’s disease [J]. Alzheimers Dement, 2014,10(1):109-114.
[9] Etsuro M, Mikio S , Koji A, et al. Vascular amyloidosis in neurodegenerative condition [J]. Drugs News Perspect , 2002 , 15:439-444.
[10] Gupta VB , Sundaram R, Martins RN. Multiplex biomarkers in blood [J]. Alzheimers Res Ther, 2013,5(3):31.
[11] Lewczuk P, Kamrowski-Kruck H, Peters O , et al. Soluble amyloid precursor proteins in the cerebrospinal fluid as novel potential biomarkers of Alzheimer’s disease: a multicenter study[J] . Mol Psychiatry, 2010, 15(2):138-145.
[12] Jack CR Jr, Holtzman DM . Biomarker modeling of Alzheimer’s disease [J] . Neuron , 2013, 80(6):1347-1358.