(上药东英(江苏)药业有限公司,江苏 南通 226009)
摘要 目的:优化培哚普利叔丁胺片粉末直压工艺处方。方法:通过星点设计-响应面法试验筛选处方配比,并通过与原研产品对比溶出曲线评价处方。结果:优化处方配比后的培哚普利叔丁胺片体外溶出行为与原研产品保持一致。结论:通过微晶纤维素含量、硬脂酸镁含量以及硬度建立的多元线性模型对于本品的处方优化具有良好的预测性。
关键词:培哚普利叔丁胺片 响应面法 处方优化
Optimization the Formulation of Perindopril tert-butylamine tablets by Design-response Surface Method
ABSTRACT OBJECTIVE To Optimization the Formulation of Perindopril tert-butylamine tablets which manufactured by Direct Compression METHODS screening the prescription proportion by the star-point design-response surface method, and evaluate the prescription by comparing the dissolution curve with the original product. RESULTS After the Optimization the dissolution behavior of Perindopril tert-butylamine tablets was consistent with the original product. CONCLUSION The multivariate linear model established by the content of microcrystalline cellulose, magnesium stearate and hardness can predict the formulation optimization of this product.
Key word:Perindopril tert-Butylamin tablets design-response surface method formulation optimization
培哚普利叔丁胺是一种ACEI类抑制剂,临床上用于质量高血压和冠心病[1]。1998年在法国首次上市。地产品种(雅施达)已在国内批准上市,并获得参比制剂地位,规格为4mg/片或8mg/片。
文献报道培哚普利叔丁胺在高温及高湿条件下分别环合或水解产生杂质F和杂质B,因此杂质B和杂质F是制剂环节质量控制的关键[2-4]。如采用传统的湿法制粒法制备培哚普利叔丁胺片,有较高的风险会增加杂质B和杂质F的含量,对产品的稳定性有极大的挑战。而雅施达的说明书提到的辅料并不适合采用湿法制粒法进行生产,所以推测施维雅采用粉末直压法制备。
综上所述,鉴于培哚普利叔丁胺原料性质,结合专利、参比制剂说明书等信息,培哚普利叔丁胺制备选择粉末直压较为合适,本研究采用响应面法优化粉末直压的处方配比,最终得到与参比制剂体外溶出曲线一致的处方。
1. 仪器与试药
1.1 仪器
2500溶出仪(Disteck);SY-2D 四用片剂测试仪Agilent 1260(G1311A四元泵,G1329A 自动进样器,G1316A柱温箱,G1314B紫外-可见光检测器),Agilent Chemstation 化学工作站;梅特勒XS105 电子分析天平;DP-30单冲压片机(国药龙立);
1.2 试药
培垛普利叔丁胺(自制)、微晶纤维素(JRS Type102)、胶态二氧化硅(德国瓦克N20P)、乳糖(T80)、硬脂酸镁(湖南展望)、雅施达(批号:2012029)
2、方法与结果
2.1培哚普利叔丁胺片的制备
按处方量称取已过80目筛的培哚普利叔丁胺原料与微晶纤维素等量递加法混合均匀,再加入稀释剂乳糖和助流剂胶态二氧化硅,最后加入适量的助流剂硬脂酸镁。每片片重为90mg,规格为4mg,采用异性8×4浅凹冲模,粉末直接压片,硬度控制为6kg~8kg,铝塑板包装,内加干燥剂,外套复合膜袋。
2.2 星点设计-响应面法优化处方
2.2.1溶出因素考察 本研究采用单因素考察对处方的各个因素进行了试验。结果发现,培哚普利叔丁胺片体外溶出行为受崩解剂用量、硬脂酸镁用量、硬度的影响较大。根据参比制剂Q45min
>80%,确定本研究Q5min、Q10min、Q15min为指标,将自制制剂与参比制剂进行比较。
2.2.2 星点设计 采用星点设计,以X1(微晶纤维素,mg)、X2(硬脂酸镁,mg)、X3(硬度,kg)的用量进行3因素5水平的优化实验,在前期单因素考察的基础上每片的优化范围X1:20mg~35mg,X2:0.45mg~0.90mg,X3:4kg~8kg;以Q5min、Q10min、Q15min为指标,采用Design Expert8.0.6软件进行分析。星点设计因素与水平见表1,星点设计与结果见表2。
表1 星点设计因素与水平
| 因素 | 水平 | ||||
| -1.682 | -1 | 0 | 1 | 1.682 | |
| X1(微晶纤维素,mg) | 20 | 23.04 | 27.50 | 31.96 | 35 |
| X2(硬脂酸镁,mg) | 0.45 | 0.54 | 0.68 | 0.81 | 0.90 |
| X3(硬度,kg) | 4 | 4.81 | 6 | 7.19 | 8 |
表2 星点设计与结果
| 序号 | X1 | X2 | X3 | Q5min,% | Q10min,% | Q15min,% |
| 1 | 27.50 | 1.13 | 6.00 | 33.18 | 63.14 | 88.13 |
| 2 | 31.96 | 0.72 | 7.19 | 35.23 | 78.60 | 99.25 |
| 3 | 35.00 | 1.13 | 6.00 | 29.99 | 62.15 | 89.62 |
| 4 | 23.04 | 1.53 | 4.81 | 43.16 | 56.31 | 78.59 |
| 5 | 27.50 | 1.13 | 4.81 | 33.48 | 64.78 | 92.48 |
| 6 | 27.50 | 1.80 | 6.00 | 27.18 | 46.89 | 64.27 |
| 7 | 27.50 | 1.13 | 6.00 | 36.17 | 65.14 | 91.99 |
| 8 | 27.50 | 1.13 | 6.00 | 36.13 | 64.16 | 92.12 |
| 9 | 23.04 | 0.72 | 7.19 | 41.77 | 81.13 | 97.23 |
| 10 | 27.50 | 1.13 | 6.00 | 37.26 | 64.88 | 88.46 |
| 11 | 27.50 | 0.45 | 6.00 | 36.19 | 76.16 | 100.52 |
| 12 | 31.96 | 1.53 | 7.19 | 26.91 | 77.26 | 66.44 |
| 13 | 20.00 | 1.13 | 6.00 | 45.27 | 66.27 | 93.16 |
| 14 | 27.50 | 1.13 | 6.00 | 36.99 | 66.28 | 92.57 |
| 15 | 23.04 | 0.72 | 4.81 | 43.18 | 54.17 | 98.66 |
| 16 | 23.04 | 0.45 | 7.19 | 34.59 | 66.28 | 76.30 |
| 17 | 27.50 | 1.13 | 6.00 | 35.11 | 63.48 | 92.53 |
| 18 | 31.96 | 0.72 | 8.00 | 29.56 | 92.36 | 96.89 |
| 19 | 27.50 | 1.13 | 4.00 | 35.03 | 63.56 | 88.30 |
| 20 | 31.96 | 1.53 | 6.00 | 26.45 | 52.48 |
2.2.3 模型拟合Design Expert8.0.6软件对试验数据进行多元线性回归,并以方程相关系数(R2)和置信度(P)为标准进行判定。
Q5min=120.62401-6.30802X1+42.11068X2+0.31955X3-0.55795X1X2+0.36584X1X3-2.14093X2X3+0.065846X12-8.54346X22-0.79409X32(R2=0.9348,P=0.0008);Q10min=56.23886+6.28773X1+48.34663X2-40.76585X3-3.70530X1X2-0.67700X1X3+10.30044X2X3+0.033893X12-8.43501X22+4.65029X32(R2=0.9059,P=0.0030);Q15min=-26.69955+5.18088X1+92.51989X2+4.73270X3-4.25783X1X2-0.26521X1X3+7.85100X2X3+0.018687X12-22.10416X22-0.55901X32(R2=0.9067,P=0.0029)
由上述模型置信度P<0.05,拟合度R2>0.9,说明模型的拟合程度良好、代表性好,可用来分析和预测培哚普利叔丁胺片的处方。
2.2.4 响应面分析 Q5min、Q10min、Q15min与三个因素的响应面图见下图1。
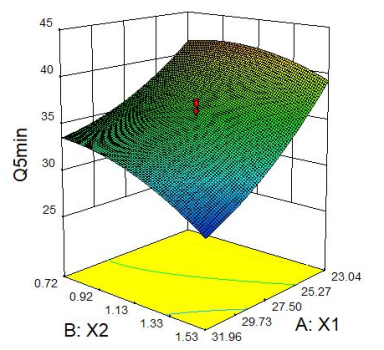


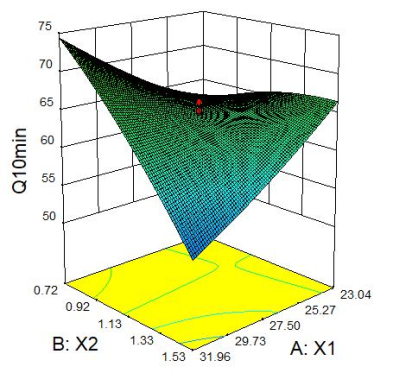
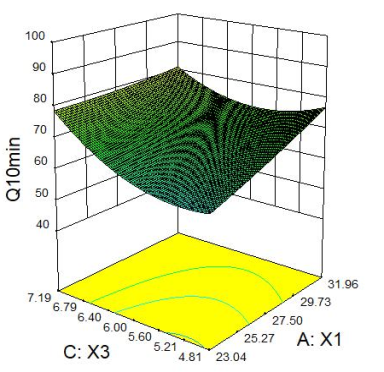
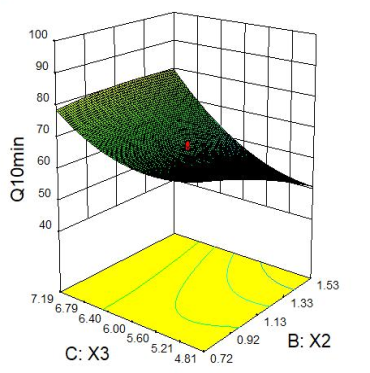
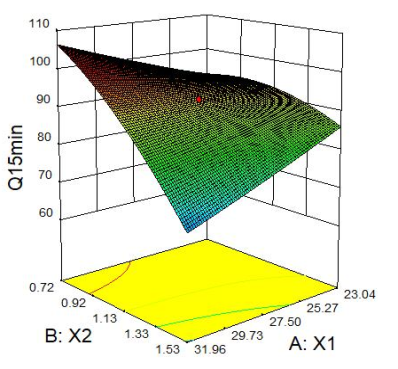
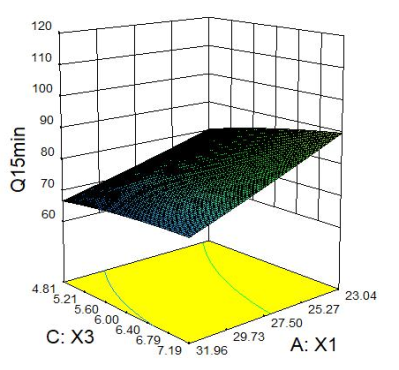
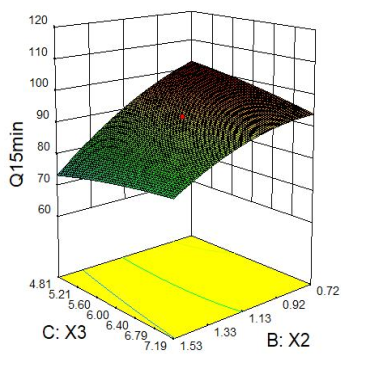
图1 Q5min、Q10min、Q15min 响应面图
2.2.5 处方优化与验证
为验证模型预测能力,将参比的Q5min、Q10min、Q15min作为目标值,经Design Exoert 8.0.6软件处理,优选处方区域为X1为23.04mg~31.96mg,X2为0.82mg~1.03mg,X3为6.35kg~7.19kg。对预测结果进行验证
由于X2 X3的变化范围较少,因此对X1高中低3个用量处方进行验证。处方1~3(微晶纤维素、乳糖、胶态二氧化硅、硬脂酸镁)配比依次为23.04mg、 61.79mg、0.27mg、0.9mg;27.5mg、 57.33 mg、0.27mg、0.9mg;31.96mg、 52.87mg、0.27mg、0.9mg;硬度控制在7kg左右,测定溶出度,结果见表3。
表3处方优化结果
| 处方号 | Q5min | Q10min | Q15min | ||||||||
| 测定值 | 预测值 | 相对误差 | 测定值 | 预测值 | 相对误差 | 测定值 | 预测值 | 相对误差 | |||
| 1 | 41.47 | 40.23 | 3.1 | 73.22 | 71.25 | 2.8 | 99.56 | 99.08 | 0.5 | ||
| 2 | 38.56 | 40.23 | -4.2 | 70.11 | 71.25 | -1.6 | 98.77 | 99.08 | -0.2 | ||
| 3 | 34.18 | 40.23 | -15 | 67.89 | 71.25 | -4.7 | 96.27 | 99.08 | -2.8 | ||
由上表可知,最优处方为处方2:每片含培哚普利叔丁胺4mg、微晶纤维素27.5mg、乳糖57.33mg、胶态二氧化硅0.27mg、硬脂酸镁0.9mg。对自制片在不同介质中测溶出度进行测定,与参比制剂比较。结果显示,在不同介质中自制片的释药行为与参比制剂基本一致,具体数据表4。
表4自制片与参比制剂的释药行为对比
| 释放介质 | 样品 | 不同时间点的溶出度 | ||
| Q5min | Q10min | Q15min | ||
| pH6.8 | 自制 | 41.87 | 69.88 | 99.28 |
| 参比 | 42.15 | 70.18 | 99.34 | |
| pH4.0 | 自制 | 39.10 | 69.04 | 91.22 |
| 参比 | 38.46 | 68.24 | 91.33 | |
| 水 | 自制 | 40.56 | 71.77 | 98.56 |
| 参比 | 40.88 | 71.96 | 98.78 | |
| 0.05mol/L 盐酸 | 自制 | 40.02 | 70.92 | 98.74 |
| 参比 | 40.23 | 71.25 | 99.08 | |
3讨论
本研究是采用粉末直压法制备培哚普利叔丁胺片,处方中乳糖作为稀释剂和骨架材料,胶态二氧化硅作为改善物料粉体学性质的助流剂,剩下的微晶纤维素既作为崩解剂又起到黏合剂的作用,由于本片是速释片,所以硬脂酸镁不仅作为润滑剂,它的水膜效应同样影响药物的释放。硬度则影响片剂的崩解,崩解的快慢则直接影响到速释制剂的溶出速率。所以微晶纤维素的用量、硬脂酸镁的用量以及硬度是影响培哚普利叔丁胺片溶出行为的关键要素。
本文通过星点设计-响应面法设计试验并结合结果进行拟合分析,建立了微晶纤维素以及硬脂酸镁含量、硬度与培哚普利叔丁胺片Q5min、Q10min、Q15min之间的多元线性模型,经实验验证,优化处方每片含培哚普利叔丁胺4mg、微晶纤维素27.5mg、乳糖57.33mg、胶态二氧化硅0.27mg、硬脂酸镁0.9mg,其溶出曲线的测定值与预测值趋势基本一致,所建立的模型有良好的预测性,在不同介质条件下与参比制剂释放行为相似。
参考文献
[1]TODD P A, FITTON A, Perindopril. A review of its pharmacological properties and therapeutic use in cardiovascular disorders [J], Drugs, 199, 42(1):90-114.
[2]COVERSYL®Tablets. 日本標準商品分類番号 872144(2014 年 6 月改訂(第 19 版): 5.
[3] YAO C Z, YU Y H, SHI X B. A stable alpha crystal form of perindopril t-butyl amine tablet and a preparation method thereof: CN, 201510885002. 8 [P]. 2015-12-04.
[4] HUANG L Q, BIAN C A. A perindopril tablet and its powder direct tableting process: CN, 201510040697.X [P]. 2015-01-07.
[5]中华人民共和国药典:四部[S],2015年版.中国医药科技出版社,2015:121-124
1作者简介:汪晓铭,中级工程师。Tel:15152875508 E-mail:xmwang@sinobp.com。
*通讯作者:汤征,中级工程师。Tel:18051666679 E-mail:ztang@sinobp.com。