广东省广州市花都区秀全中学 510800
化学平衡常数的计算是近年来高考题中的高频考点,学生要解决这一类题型需要有一定的信息加工、数据处理、计算能力,对学生的学科素养要求比较高,是学生得分的难点,特别近几年对化学平衡常数的考查灵活多变,本文通过分析题型建立提炼答题模型,提高答题的速率和准确率,让备考事半功倍。
一、浓度平衡常数Kc的计算:
【例题1:2018·全国卷II】CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)==2CO(g)+2H2(g)。
某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为_______mol2·L−2。
【思维点拨】某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,根据已知信息和方程式的关系可知
CH4(g)+CO2(g)= 2CO(g)+2H2(g)
起始浓度(mol/L) 1 0.5 0 0
转化浓度(mol/L) 0.25 0.25 0.5 0.5
平衡浓度(mol/L) 0.75 0.25 0.5 0.5
所以其平衡常数为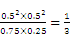 mol2·L−2。
mol2·L−2。

【提炼答题模型】利用已知条件列出3段式(起、转、平)的量→再列出公式→代入数据计算→写出计算结果。
【对点练习:2017国乙28】H2S与CO2在高温下发生反应:H2S(g)+CO2(g) ①H2S的平衡转化率 =_______%,反应平衡常数K=________。
=_______%,反应平衡常数K=________。
【思维点拨】在610 k时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02,设CO2转化了xmol,根据信息可以得到:
H2S(g) + CO2(g)![]() COS(g)+ H2O(g)
COS(g)+ H2O(g)
起始量(mol) 0.40 0.10 0 0
转化量(mol) x x x x
平衡量(mol) 0.40-x 0.10-x x x

解得x=0.01mol,所以H2S的转化率是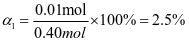
由于该反应是反应前后气体体积相等的反应,所以在该条件下反应达到平衡时化学平衡常数 ;
;
压强平衡常数Kp的计算:
【例题2:2014课标全国Ⅰ】乙醇是重要的有机化工原料,可由乙烯气相直接水合法生产:C2H4 (g)+H2O(g)![]() C2H5OH(g)下图为气相直接水合法中乙烯的平衡转化率与温度.压强的关系(其中n(H2O)︰n(C2H4)=1︰1)
C2H5OH(g)下图为气相直接水合法中乙烯的平衡转化率与温度.压强的关系(其中n(H2O)︰n(C2H4)=1︰1)
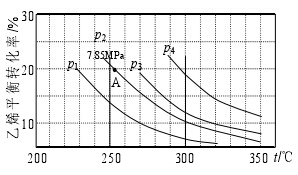
列式计算乙烯水合制乙醇反应在图中A点的平衡常数K=_______________
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
【思维点拨】:根据题目信息可知n(H2O)︰n(C2H4)=1︰1,从图像中得到A点的转化率为20%,利用起、转、平的关系可以得到平衡状态下各组成的量,再利用分压=总压×物质的量分数求出各组分的分压,代入Kp的公式就可以了,所以Kp的计算是在Kc的基础上再加多一步求分压的步骤。
C2H4(g)+H2O(g) ![]() C2H5OH(g)
C2H5OH(g)
n0 (mol) n n 0
△n (mol) 0.20n 0.20n 0.20n
n平(mol) 0.80n 0.80n 0.20n
分压=总压×物质的量分数
![]()
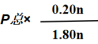
p(C2H4)=p(H2O)= p(C2H5OH)=

【提炼答题模型】
1、利用已知条件列出3段式(起、转、平)的量
2、弄清楚核心公式:Kp的表达式,分压=总压×物质的量分数
3、关注平衡时的压强与起始的压强是否相同:题目是恒压,反应前后气体体积是否相等

【对点练习:2020·新课标Ⅰ】硫酸是一种重要的基本化工产品,接触法制硫酸生产中的关键工序是SO2的催化氧化:SO2(g)+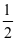 O2(g)
O2(g)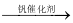 SO3
SO3
(g) ΔH=−98 kJ·mol−1。回答下列问题:(2)当SO2(g)、O2(g)和N2(g)起始的物质的量分数分别为7.5%、10.5%和82%时,在0.5MPa、2.5MPa和5.0MPa压强下,SO2平衡转化率α随温度的变化如图所示。

将组成(物质的量分数)为2m% SO2(g)、m% O2(g)和q% N2(g)的气体通入反应器,在温度t、压强p条件下进行反应。平衡时,若SO2转化率为α,则SO3压强为___________,平衡常数Kp=___________(以分压表示,分压=总压×物质的量分数)。
【思维点拨】:根据压强对化学平衡的影响,分析图中数据找到所需要的数据列出起、转、平三段式;根据恒压条件下总压不变,求出各组分的分压,进一步可以求出平衡常数;
假设原气体的物质的量为100mol,则SO2、O2和N2的物质的量分别为2m mol、m mol和q mol,2m+m+q=3m+q=100,SO2的平衡转化率为α,则有下列关系:
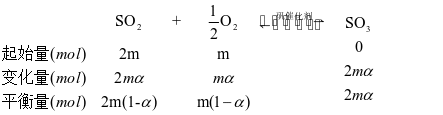
平衡时气体的总物质的量为n(总)= 2m(1-α)+m(1-α)+2mαmol+q mol,则SO3的物质的量分数: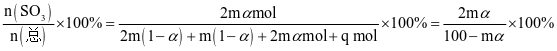 该反应在恒压容器中进行,因此,SO3的分压p(SO3)=
该反应在恒压容器中进行,因此,SO3的分压p(SO3)=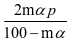 ,p(SO2)=
,p(SO2)=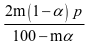 ,p(O2)=
,p(O2)=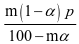 ,在该条件下,SO2(g)+
,在该条件下,SO2(g)+ 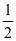 O2(g)⇌2SO3(g) 的Kp=
O2(g)⇌2SO3(g) 的Kp=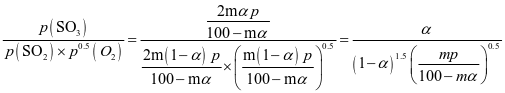 。
。
速率常数与平衡常数:
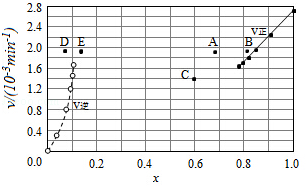
【例题3:2015国乙28】碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:Bodensteins研究了下列反应:2HI(g)⇌ H2(g)+I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
上述反应中,正反应速率为v正= k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为 (以K和k正表示)。若k正=0.0027min-1,在t=40min时,v正= min-1。
【思维点拨】知识要点:平衡状态下,v正= v逆,故有:k正·x2(HI) = k逆·x(H2)·x(I2)

【提炼答题模型】平衡状态下,v正= v逆,根据正逆速率的等式与平衡常数的表达式进行计算变形,得出速率常数和平衡常数的关系。
变形:k正/ k逆={ x(H2)·x(I2)}/ x2(HI)=K,故有: k逆= k正/K
【对点练习:2018国丙28】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。回答下列问题:对于反应2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。

比较a、b处反应速率大小:va________vb(填“大于”“小于”或“等于”)。反应速率v=v正−v逆=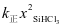 −
−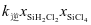 ,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处
,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处 =__________(保留1位小数)。
=__________(保留1位小数)。
【思维点拨】a、b两点的转化率相等,可以认为各物质的浓度对应相等,而a点的温度更高,所以速率更快,即Va>Vb。根据题目表述得到![]() ,
,![]() ,当反应达平衡时
,当反应达平衡时![]() ,
,![]() =
=![]() ,
,![]() 所以
所以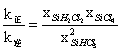 ,实际就是平衡常数K值,所以
,实际就是平衡常数K值,所以![]() 0.02。
0.02。
高考是一个选拔性的考试,要求有一定的梯度和区分度,如果将学生在高考中相对比较难的考点进行题型探究,提炼出解题的思维模型,进行对点练习,达到高效备考。